南昌大学第一附属医院
临床试验研究中心

发展历程
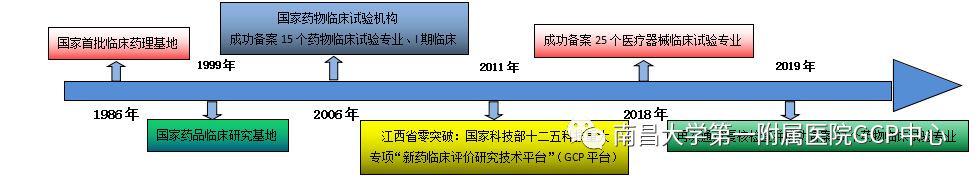
我院临床试验研究中心(GCP中心)前身为1986年由卫生部首批确定的临床药理基地。1999年被国家食品药品监督管理局批准为“国家药品临床研究基地”,2006年通过国家食品药品监督管理局药物临床试验机构资格认定现场检查,认定为“国家药物临床试验机构”,并于2012年、2015年及2019年再次通过认定复核检查并完成药物临床试验机构备案(药临床机构备字2019000065)。2018年完成医疗器械临床试验机构备案(械临机构备201800203)。2018年8月,正式更名为南昌大学第一附属医院临床试验研究中心(GCP中心)。
中心概况
GCP中心组织机构健全,人才济济、实力雄厚,中心下设机构办公室、质量管理室、档案管理室、药物I期临床试验病区和中心药房5个部门,是中国药理学会药物临床试验专委会常委和江西省药物临床试验与研究协会副理事长单位。中心现有专职工作人员15人,其中博士研究生5名、硕士研究生6名,其中国家药物临床试验机构资格认定和复核检查、GCP数据现场核查专家3人。近年来,GCP中心奋发向上、励精图治,依托医院雄厚的专业实力,实现快速高质量发展,承担科技部“十二五”重大专项、“十三五”重大专项、国家自然科学基金等各级各类课题共16项,以第一作者/通讯作者身份发表高水平学术论文70余篇,其中SCI论文25篇。获得发明专利1项(CN 109503695 B)、江西省自然科学科技二等奖1项(Z-19-2-03-R01)。已获得药物临床试验资格的专业有:消化、呼吸、心血管、内分泌、肿瘤、血液、神经内科、烧伤、感染、肾病、泌外、普外、骨科、眼科、风湿免疫、康复医学、中西医结合、皮肤、口腔、疼痛、耳鼻咽喉、神经外科、胸外、麻醉、急诊外科、精神、妇产及I期临床试验研究室,可以承担药物I-IV期、生物等效性试验;已获得医疗器械临床试验资格备案的专业有:烧伤、消化、心血管、肾病、骨科、泌外、普外、神经外科、胸外、心脏大血管外科、整形外科、妇产、耳鼻咽喉、眼科、口腔、疼痛、康复、麻醉、中西医结合、病理、医学检验、医学影像等,可以承担各类医疗器械及体外诊断试剂的研究。近几年接受国家药品监督管理局食品药品审核查验中心(CFDI)现场核查17次及飞行检查1次,均顺利通过。经过30余年的不断发展和几代人的奋力拼搏,GCP中心现已成为医院开展新药临床试验研究和研究者发起的临床研究(IIT)主要平台,为医院的临床学科发展和我国的新药临床研究做出了卓越的贡献。
高效的信息化建设
GCP中心自主构建了临床试验全流程信息化管理系统,包括临床项目试验管理系统(CTMS)、临床试验电子处方管理信息系统、临床试验药物管理信息系统和CRC系统,进一步实现了我院各专业临床试验实施的标准化、系统化、流程化管理,促进我院临床试验的规范化实施,保障我院临床试验的专业化质量
1、临床项目试验管理系统(CTMS)
通过临床试验实施过程主要节点的信息化管理,对临床试验5大阶段进行系统化管理(立项申请—伦理审查—合同签署—试验实施—试验结题),从而实现对试验项目管理的实时跟踪及质量监督,同时使物资管理、经费管理信息化,极大提高临床试验管理效率,保证临床试验各项工作顺利进行。
2、临床试验电子处方管理信息系统
与医院HIS对接,规范试验药物电子处方书写,通过条码识别、发药信息自动验证以及专业药师的处方审核,做到临床试验用药可标识、可跟踪,为临床试验用药提供信息化技术保障。
3、临床试验药物管理信息系统
对试验用药品的寄送、交接、入库、管理、发放、回收、返还整个流转过程实现信息化管理,有效规避药品管理风险,保障受试者用药安全和数据真实、完整、规范。
4、CRC系统
进行SMO优选、CRC考核、CRC工作动态记录,实现CRC人员的全流程监管,充分保障临床试验全过程质量安全。
GCP中心宗旨
GCP中心将继续秉持药道为民、药研至真、惟实励新、惟诚致远的精神,不断优化试验流程和SOP体系,积极探索高效优质的研究管理模式,以保障受试者权益和安全为中心,加速创新药物的临床评价及成果转化,为药物创新研发事业做出应有贡献。

